One Step Cloning Kit (1-7 Fragments) 通用一步法克隆试剂盒(1-7片段)
产品简介
本品是新一代的同源重组克隆试剂盒,精心优化的重组酶和重组反应所需缓冲液,并添加了独特的重组增强因子,可显著提高重组克隆效率。本试剂盒可以将PCR产物定向克隆至任何载体的任何位点,兼容未纯化PCR产物、直接回收的PCR产物、低浓度的胶回收产物。本产品可重组同源臂GC含量30%-70%的DNA片段。将载体完全线性化,并在插入片段正、反向PCR引物5’端引入15-25 bp的线性化载体末端同源序列,使得插入片段PCR产物5’和3’末端分别带有与线性化载体两末端对应的完全一致的序列。PCR产物和线性化载体在重组酶的作用下,在50℃条件下最快仅需5 min即可完成重组反应,克隆阳性率可达95%以上。
产品规格
|
产品货号 |
N132081S |
N132081M |
|
产品规格 |
20 T |
50 T |
组分信息
|
组分编号 |
组分名称 |
N132081ES20 (20 T) |
N132081ES50 (50 T) |
|
N132081-A |
2 × Clone Enzyme Premix |
200 μL |
500 μL |
|
N132081-B |
500 bp control insert (25 ng/μL) |
5 μL |
5 μL |
|
N132081-C |
pUC 19 control vector, linearized (50 ng/μL) |
5 μL |
5 μL |
|
N132081-D |
LB Powder预混培养基 |
- |
3×0.5 L |
产品储存
组分A、B、C:-25~-15℃保存,有效期1年。
组分D:室温保存,有效期2年。
注意事项
1.需自备的材料:
1)自备样品:自备好线性化载体和插入片段。
2)自备试剂(仅罗列部分):
a. 超级感受态:转化效率>108 cfu/μg。
b. 高保真酶:2×High-Fidelity Fast PCR Master Mix (With Dye)(Cat#N132016)或其他等效产品。
c. 快速菌落PCR mix:2×HotStart Fast PCR Master Mix (With Dye)(Cat#N132001)或其他等效产品。
d. 核酸染料:Nucleic Acid Gel Stain (10,000× in Water)(Cat#N132109),适用于紫外凝胶成像仪,或其他等效产品。
3)自备仪器耗材(仅罗列部分):PCR仪,水平电泳槽,切胶仪,EP管等。
4)制备LB液体培养基、固体平板,操作步骤参考“5. LB培养基配制”。
2. 为了您的安全和健康,请穿实验服并佩戴一次性手套操作。
3. 本产品仅作科研用途!
操作说明
1. 实验流程

2. 目标载体及插入片段制备
1) 线性化载体的制备
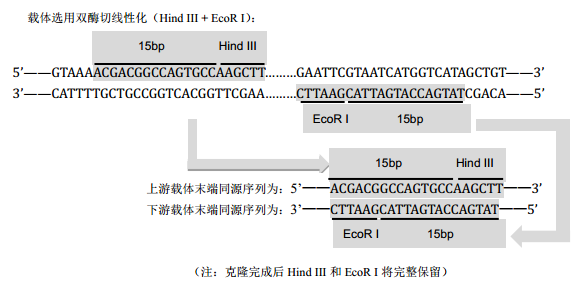
选择合适的克隆位点,并对载体进行线性化。本产品不受同源臂区域GC含量影响。线性化载体可通过限制性内切酶酶切或反向PCR扩增获得。
a. 酶切制备线性化载体*
双酶切线性化:线性化完全,转化背景低。
单酶切线性化:线性化程度较差。可适当延长酶切时间以降低转化背景。
*不含插入片段的假阳性克隆可能是由线性化不完全的环状载体转化而形成的,若这种假阳性克隆比例较高,建议重新制备线性化载体并切胶回收。
b. 反向PCR扩增制备线性化载体
建议使用高保真聚合酶(如:2×High-Fidelity Fast PCR Master Mix (With Dye) Cat#N132016)进行载体扩增,以减少扩增突变的引入。PCR扩增模板应尽量使用预线性化质粒,以防止残留环状质粒模板对克隆阳性率的影响。
重组反应体系兼容几乎所有酶切反应体系和常规PCR反应体系,当载体酶切产物或反向PCR扩增产物纯度较高时,可以无需纯化,直接进行重组反应。但纯度较低且有可能含有未线性化环状质粒时,建议使用高质量的试剂盒对线性化载体进行胶回收纯化,以提高产物纯度并去除一部分未线性化的环状载体,有利于提高重组效率。
2) 单个插入片段的引物设计
引物设计方式:通过在插入片段正、反向PCR引物的5’端引入15-25 bp(不包括酶切位点)的线性化载体末端同源序列,使得插入片段PCR产物5’和3’末端分别带有与线性化载体两末端对应的完全一致的序列。
插入片段正向扩增引物设计方式:
5’-上游载体末端同源序列 + 酶切位点(可保留或删除)+ 基因特异性正向扩增引物序列-3’
插入片段反向扩增引物设计方式:
3’-基因特异性反向扩增引物序列 + 酶切位点(可保留或删除)+ 下游载体末端同源序列-5’
推荐使用成熟的克隆软件进行引物设计,自动生成插入片段的扩增引物。最终引物长度超过40 bp,建议选用PAGE纯化方式进行引物合成。计算扩增引物退火温度时,只需计算基因特异性扩增序列的Tm值,载体末端同源序列不应参与计算,为了得到高效率克隆,建议Tm≥48℃。

3) 多个插入片段的引物设计
引物设计方式参考:通过在插入片段正、反向PCR引物的5’端引入15-25 bp(不包括酶切位点)的线性化载体末端同源序列,使得插入片段PCR产物5’和3’末端分别带有与线性化载体两末端对应的完全一致的序列。
推荐使用成熟的克隆软件进行引物设计,自动生成插入片段的扩增引物。若手动设计,可参照以下实例。以在pUC18载体的EcoR I和Hind III酶切位点间插入三段基因的引物设计为例,引物具体设计方案如下:
a. 首先设计第一片段的正向扩增引物和第三片段的反向扩增引物(与载体相邻的两个插入片段)。
第一片段正向扩增引物设计方式:
5’-上游载体末端同源序列+酶切位点(可保留或删除)+ 第一片段基因特异性正向扩增序列-3’
第三片段反向扩增引物设计方式:
3’-第三片段基因特异性反向扩增序列 + 酶切位点(可保留或删除)+ 下游载体末端同源序列-5’

b. 其次设计第一片段的反向扩增引物和第二片段的正向扩增引物。用于片段之间进行重组的同源序列可以添加至前方片段的反向扩增引物中,也可以添加至后方片段的正向扩增引物中,还可以两片段各添加一部分。以将同源序列添加至前方片段(第一片段)的反向扩增引物中为例:
第一片段反向扩增引物设计方式:
3’-第一片段基因特异性反向扩增序列 + 第二片段5’端同源序列-5’
第二片段正向扩增引物设计方式:
5’-第一片段5’端同源序列-第二片段基因特异性正向扩增序列-3’
c. 最后设计第二片段的反向扩增引物和第三片段的正向扩增引物。设计方式与第一片段的反向扩增引物和第二片段的正向扩增引物设计方式一致。
4) 插入片段PCR扩增
插入片段扩增可用任意PCR酶扩增,无需考虑产物末端有无A尾(重组过程中将被去除,在最终载体中不会出现)。但为了减少扩增突变的引入,建议使用高保真聚合酶进行扩增(如:2×High-Fidelity Fast PCR Master Mix (With Dye)(Cat#N132016)。
PCR扩增结束后,取少量产物进行琼脂糖凝胶电泳以检验扩增产量和特异性。重组反应体系兼容常规PCR反应体系。因此,如果扩增模板不是与载体抗性相同的环状质粒,且PCR产物电泳条带单一,则扩增产物可以无需纯化,直接用于重组反应。但PCR扩增产物纯度较低时,建议使用高质量的试剂盒对PCR扩增产物进行胶回收纯化,以提高产物纯度,有利于提高重组效率。
3. 浓度测定
推荐使用琼脂糖凝胶电泳比较条带亮度的方法对DNA进行定量。将线性化载体和插入片段扩增产物做数个等体积稀释梯度,原始产物和稀释后产物各取1 μL进行琼脂糖凝胶电泳,与DNA分子量标准(DNA Marker)(Cat#N132117-N132119)比较条带亮度以确定其近似浓度(尤其针对于线性化载体和插入片段扩增产物未纯化的情况)。也可通过核酸浓度测定仪对线性化载体和插入片段进行测定,记录浓度值(ng/μL)和OD260/OD280值后进行投入量的计算。
4. 重组反应
1) 线性化载体和插入片段使用量
重组反应体系各个片段及载体插入总浓度为0.02 - 1 pmol。载体与各个插入片段摩尔比为1:2*。对应的DNA质量可由以下公式计算获得:

50 ng 5,000 bp的DNA片段约为0.015 pmol
50 ng 500 bp的DNA片段约为0.15 pmol
*当插入片段长度>载体时,最适载体与插入片段使用量的计算方式应互换,即插入片段当做载体,载体当做插入片段进行计算。
**线性化载体及插入片段的反应终浓度最低可达到1 ng/μL。当上述公式计算的值低于或超过体系范围时,直接使用最低/最高投入量即可。
***线性化载体和插入片段扩增产物未纯化直接使用时,使用总体积应不超过反应体系体积的1/5,如20 μL体系不超过4 μL。
简便计算公式: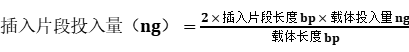
2) 重组反应体系(可等比扩大或缩减反应体系,冰上配制,各组分使用前需混匀)
表1 反应体系
|
组分 |
重组反应体系 |
阳性对照 |
阴性对照-A |
阴性对照-B |
|
2× Clone Enzyme Premix |
10 μL |
10 μL |
0 μL |
0 μL |
|
每个插入片段投入量 |
X μL |
1 μL(N132081-B) |
0 μL |
X μL |
|
目的载体投入量 |
Y μL |
1 μL(N132081-C) |
Y μL |
0 μL |
|
ddH2O |
To 20 μL |
To 20 μL |
To 20 μL |
To 20 μL |
阳性对照:排除实验材料及操作因素的影响。
阴性对照-A:确认线性化载体有无环状质粒残留;阴性对照-B:当插入片段原始质粒与载体有相同抗性时,确认插入片段有无环状质粒残留。
3) 重组反应条件
a. 体系配制完成后,用移液器轻轻吸打混匀各组分,短暂离心将反应液收集至管底。
b. 当插入1个片段时,反应条件为50℃,5 min,阳性对照的反应条件也为50℃,5 min;当插入片段数为2-6个时,建议反应条件为50℃,10 -50 min(反应时间随片段数增多而延长,如表2所示)。超长载体片段连接,建议反应时间为40-60 min。
表2 反应时间
|
连接片段数 |
重组反应时间 |
|
2 |
10 min |
|
3 |
20 min |
|
4 |
30 min |
|
5 |
40 min |
|
6 |
50 min |
c. 反应产物可直接进行转化,也可储存于-20℃,待需要时解冻转化。
5. LB培养基配制(此步骤在实验准备阶段进行)
1) LB液体培养基
取LB Powder预混培养基一袋12.5 g,撕开包装,倒入烧杯中,加入450 mL双蒸水溶解,定容至0.5 L。分装到250 mL三角瓶中,每瓶倒入100 mL培养基,封口膜封口。置于高压灭菌锅中,121℃,灭菌20 min。灭菌后,待温度降到40℃以下使用。
【注】:本产品加入pH7.0的去离子水后,pH值(25℃)7.0 ± 0.1,无需调节pH即可使用。
2) LB固体培养基
取LB Powder预混培养基一袋12.5 g,撕开包装,倒入烧杯中,添加7.5 g琼脂粉,加入450 mL双蒸水溶解,定容至0.5 L。分装到250 mL三角瓶中,每瓶倒入100 mL培养基,封口膜封口。置于高压灭菌锅中,121℃,灭菌20 min。灭菌后,待温度降到60℃以下,倒平板。静置15 min以上,待平板培养基凝固后使用。
6. 转化
1)普通转化
a. 在冰上解冻克隆感受态细胞(如:DH5α Chemically Competent Cell)。
b. 取10 μL冷却重组产物,加入到100 μL感受态细胞中,轻弹管壁数下混匀,在冰上放置25 min。
c. 42℃热激60 sec,冰浴孵育2 min。
d. 加入500 μL SOC或LB液体培养基,37℃,200 rpm,摇菌60 min。
e. 5,000 rpm离心4 min,弃上清至100 μL。用剩余培养基将菌体重悬,用无菌涂布棒在含有正确抗性的平板上轻轻涂匀。待菌液被吸收,将平板倒置,于37℃过夜培养。
2)10 min快速转化
提前15分钟将用到的筛选培养基平板拿到37℃预热。将F-DH5α感受态细胞从-80℃拿出迅速插入冰上,待菌体融化,加入目的DNA(质粒或连接产物),轻轻弹匀,冰浴静置5 min。
*所加DNA体积不要超过感受态细胞悬液体积的十分之一。
c. 用200 μL移液枪将上一步的混合物转移到已经37℃预热的LB培养基上,均匀涂布。
d. 将平板置于37℃培养箱倒置过夜培养。若进行蓝白斑筛选操作,平板在37℃至少倒置培养15 h。
7. 克隆鉴定
最方便快捷的方法是菌落PCR。用无菌的枪头或牙签将单个菌落挑至新一代快速菌落PCR Mix中混匀(如:2×HotStart Fast PCR Master Mix (With Dye),Cat#N132001),加入引物直接进行PCR反应。推荐至少使用一条通用测序引物进行菌落PCR,可以避免PCR假阳性的产生。阳性对照的菌落PCR建议用M13F/M13R引物进行验证。后续也可用于酶切或测序鉴定。
目录号:*
姓名*
手机号:*
份额:*
邮箱*
国家:*
公司/机构:*

